导读: 在医学研究领域,科学家们正在不断探索如何通过新型技术手段抑制癌症的发展。本文将从个人视角出发,深入探讨腺病毒载体调控乳铁蛋白对宫颈癌干细胞增殖的影响机制,并结合最新研究成果进行详细解析。
一、腺病毒载体2.0:突破传统限制
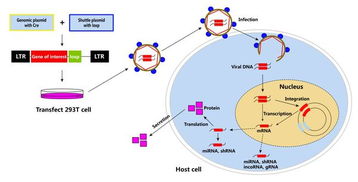
作为一名科研爱好者,在了解腺病毒载体技术时,我被其潜力深深吸引。第一代PROTAR疫苗技术虽然已经实现了PTD装载在病毒蛋白两端的功能,但这种局限性显然无法满足更广泛的应用需求。幸运的是,科学家团队开发了PROTAR疫苗2.0版本,它不仅支持PTD元件装载在病毒蛋白的任意位点,还能够实现多个PTD元件的同时装载。这意味着未来我们可以设计更加灵活和高效的疫苗方案,为攻克宫颈癌等疾病提供了新的可能性。
二、肿瘤干细胞特性与铁死亡敏感性
进一步研究发现,肿瘤干细胞对铁死亡高度敏感。DKK1调控下的肿瘤干细胞特性抑制可以保护肺转移细胞免受铁死亡影响,从而促进转移灶生长。这一发现揭示了一个重要的治疗方向——通过干预肿瘤的转移性克隆化增殖步骤,而非仅仅关注肿瘤侵袭过程,可能带来更好的疗效。这项创新性策略为后续研究奠定了坚实基础。
三、EZH2/AKT抑制剂联用机制
与此同时,EZH2/AKT抑制剂联用的研究也取得了显著进展。研究表明,EZH2抑制剂能够打开GATA3增强子位点的染色质结构;而AKT抑制剂则负责诱导FOXO1去磷酸化,增强其进入细胞核的能力,进而促进GATA3编码基因的转录。这种协同作用最终提升了GATA3水平,推动基底型TNBC细胞向管腔样细胞状态转变,为乳腺癌治疗提供了新思路。
四、N-糖基化修饰与免疫逃避
此外,干扰素γ受体蛋白的稳定性受到N-糖基化修饰的影响。当该蛋白在特定位置(如Asn150或Asn261)发生N-糖基化后,其信号通路会被抑制,导致结直肠癌细胞产生免疫逃避现象。这一发现为我们理解肿瘤免疫逃逸机制提供了全新视角,并可能指导未来药物研发的方向。
五、铁死亡诱导与肿瘤微环境调节
RSL3@LIPO@GEL是一种能够有效诱导乳腺癌铁死亡的化合物。它通过释放特定物质与免疫细胞相互作用,逆转肿瘤微环境中的免疫抑制状态,从而达到抑制肿瘤生长的目的。铁死亡作为一种新型细胞程序性死亡方式,在肿瘤增殖及化疗耐药方面扮演着重要角色,值得我们持续关注。
六、lncRNA CCDST的作用
最后不得不提的是长链非编码RNA(lncRNAs)。这类分子尽管不具备高蛋白质编码潜能,却在胚胎发育和肿瘤发展中发挥了重要作用。例如,LncRNA CCDST通过破坏MDM2和DHX9之间的相互作用,在HPV阳性宫颈癌中展现出独特功能。这表明lncRNAs可能是未来抗癌治疗的重要靶点之一。
总结: 腺病毒载体技术、铁死亡机制以及多种新型疗法的联合应用,正逐步揭开宫颈癌干细胞增殖背后的奥秘。希望这些前沿研究成果能够早日转化为临床实践,造福更多患者。
快速导航:
一、腺病毒载体2.0:突破传统限制
二、肿瘤干细胞特性与铁死亡敏感性
三、EZH2/AKT抑制剂联用机制
四、N-糖基化修饰与免疫逃避
五、铁死亡诱导与肿瘤微环境调节
六、lncRNA CCDST的作用

发表评论 取消回复